電子殻と電子軌道 [C3J-東大化学 日記]
こんにちは~ (*^_^*)/
さて、C3JとC3JXは同じテキストを使用しますが、選抜クラスであるC3JXはC3Jの発展的な内容を学ぶ予定です。例えば、春期講習の第1日目は、C3Jでは原子の構造(電子配置,原子半径,イオン半径,元素の性質の違いなど)と同位体が主なテーマですが、C3JXでは原子の構造の発展的な内容(有効核電荷,電子軌道論,軌道の混成など)や化学結合論に重点を置きます。もちろん、どちらも入試で出題される内容ですよ。なお、こちらでは全内容を扱います(授業時間が倍だから・・・)。
さて、今回は、前回の電子軌道の話を引き継いで、原子の電子配置と電子軌道の関係について説明します。
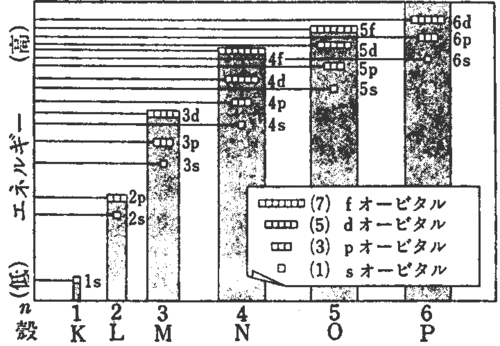
電子軌道のエネルギー準位(軌道の持つエネルギーの大きさ)は下図のようになります。エネルギーが小さいほど、物質は安定なので、電子はなるべくエネルギー準位の低い(入るのに必要なエネルギーが小さい)電子軌道へと入ります。
最外殻電子 = 基底状態(最も安定な状態)で原子の最も外側の電子殻に入っている電子
周期 =最外殻(電子の入っている電子殻のうち最も外側の電子殻)の主量子数
2.電子配置
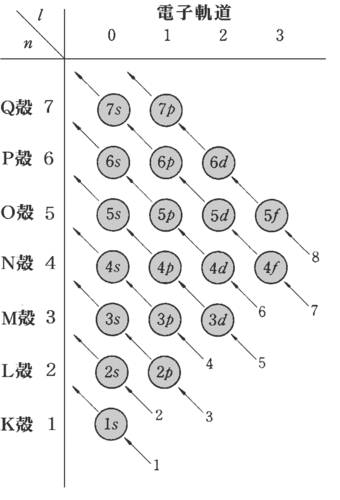
電子はできるだけエネルギー準位の低い電子軌道に入っていくので、電子が電子軌道に入る順番は、図のようになります。各電子軌道には1組の電子対(逆向きの自転(スピン)をもつ2個の電子)までしか入れない(パウリの排他原理)ので、各電子殻には最大で2n2 個の電子が入ることが出来ます。
・最外殻電子が8個までしか入らない理由各電子殻のd軌道よりも、1つ大きい(外側の)電子殻のs軌道の方がエネルギー準位が低いので、ある電子殻のp軌道が一杯になると、その次の電子は同じ電子殻のd軌道ではなく、1つ大きい(外側の)電子殻のs軌道へと入ることが分かります。つまり、最外殻電子が8個になると、次の1個はその外側の電子殻に入るので、周期が変わってしまいます。よって、最外殻電子が入ることの出来る電子軌道はs軌道とp軌道のみなので最外殻に入ることの出来る電子は8個までということになります。
・典型元素 = 同一周期で族番号(原子番号)が増えるにつれ最外殻電子が一つずつ増える希ガスを除く典型元素の最外殻電子を価電子と呼びます。価電子の数が等しい同族元素は互いに化学的性質が似ているのは知っていますよね。
・遷移元素 = 第4周期以降の3族~11族の元素最外殻がN殻以降になると、最外殻のs軌道に電子が入った後に、内殻(最外殻以外の内側にある電子殻)のd軌道に電子が入ります。これを反転充填といい、反転充填している元素が遷移元素です。したがって、遷移元素の最外殻はs軌道電子のみなので、最外殻電子の数は2個となるのです。だから、遷移元素のイオンには2価の陽イオンが多いのです。
・12族が典型元素に分類される理由電子が軌道へ充填されていくときのお約束として、同じ種類の電子軌道に電子が入っていくとき、なるべく1個ずつ入る(フントの法則・フントの規則)という法則があります。また、電子配置の安定性として、「同じ種類の電子軌道に全て電子対」が入った状態が最も安定で、「同じ種類の電子軌道に全て不対電子」が入った状態もそれなりに安定となるため、例えば6族のクロムの電子配置は、「N殻の4s軌道に電子対,内殻の3d軌道の4つに不対電子」より「N殻の4s軌道に不対電子,内殻の3d軌道の全てに不対電子」の方が安定なのです(∴ Crの最外殻電子の数は1個)。同様に、11族の元素も、「N殻の4s軌道に電子対,内殻の3d軌道の4つに電子対で残り1つに不対電子」より「N殻の4s軌道に不対電子,内殻の3d軌道の全てに電子対」の方がはるかに安定なので、最外殻電子が1個となります。すると、11族から12族へ原子番号が1つ増加したとき、最外殻電子が1個から2個へと増加することになり、これは典型元素の電子配置となるため、12族は典型元素に分類されるのです。
という訳で、以下のような電子配置になるのです。
== 基底状態の電子配置表 ==
| 族 | 元素 記号 | 原子 番号 |
K | L | M | N | O | P | |||||||||||
| 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | 6s | 6p | 6d | |||
| 1 | H | 1 | 1 | ||||||||||||||||
| 18 | He | 2 | 2 | ||||||||||||||||
| 1 | Li | 3 | 2 | 1 | |||||||||||||||
| 2 | Be | 4 | 2 | 2 | |||||||||||||||
| 13 | B | 5 | 2 | 2 | 1 | ||||||||||||||
| 14 | C | 6 | 2 | 2 | 2 | ||||||||||||||
| 15 | N | 7 | 2 | 2 | 3 | ||||||||||||||
| 16 | O | 8 | 2 | 2 | 4 | ||||||||||||||
| 17 | F | 9 | 2 | 2 | 5 | ||||||||||||||
| 18 | Ne | 10 | 2 | 2 | 6 | ||||||||||||||
| 1 | Na | 11 | 2 | 2 | 6 | 1 | |||||||||||||
| 2 | Mg | 12 | 10 ネオン核 | 2 | |||||||||||||||
| 13 | Al | 13 | 2 | 1 | |||||||||||||||
| 14 | Si | 14 | 2 | 2 | |||||||||||||||
| 15 | P | 15 | 2 | 3 | |||||||||||||||
| 16 | S | 16 | 2 | 4 | |||||||||||||||
| 17 | Cl | 17 | 2 | 5 | |||||||||||||||
| 18 | Ar | 18 | 2 | 6 | |||||||||||||||
| 第4周期 | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | 6s | 6p | 6d | ||
| 1 | K | 19 | 2 | 2 | 6 | 2 | 6 | 1 | |||||||||||
| 2 | Ca | 20 | 18 アルゴン核 |
2 | |||||||||||||||
| 3 | Sc | 21 | 1 | 2 | |||||||||||||||
| 4 | Ti | 22 | 2 | 2 | |||||||||||||||
| 5 | V | 23 | 3 | 2 | |||||||||||||||
| 6 | Cr | 24 | 5 | 1 | |||||||||||||||
| 7 | Mn | 25 | 5 | 2 | |||||||||||||||
| 8 | Fe | 26 | 6 | 2 | |||||||||||||||
| 9 | Co | 27 | 7 | 2 | |||||||||||||||
| 10 | Ni | 28 | 8 | 2 | |||||||||||||||
| 11 | Cu | 29 | 10 | 1 | |||||||||||||||
| 12 | Zn | 30 | 10 | 2 | |||||||||||||||
| 13 | Ga | 31 | 10 | 2 | 1 | ||||||||||||||
| 14 | Ge | 32 | 10 | 2 | 2 | ||||||||||||||
| 15 | As | 33 | 10 | 2 | 3 | ||||||||||||||
| 16 | Se | 34 | 10 | 2 | 4 | ||||||||||||||
| 17 | Br | 35 | 10 | 2 | 5 | ||||||||||||||
| 18 | Kr | 36 | 10 | 2 | 6 | ||||||||||||||
| 第5周期 | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | 6s | 6p | 6d | ||
| 1 | Rb | 37 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 1 | ||||||||
| 2 | Sr | 38 | 36 クリプトン核 | 2 | |||||||||||||||
| 3 | Y | 39 | 1 | 2 | |||||||||||||||
| 4 | Zr | 40 | 2 | 2 | |||||||||||||||
| 5 | Nb | 41 | 4 | 1 | |||||||||||||||
| 6 | Mo | 42 | 5 | 1 | |||||||||||||||
| 7 | Tc | 43 | 5 | 2 | |||||||||||||||
| 8 | Ru | 44 | 7 | 1 | |||||||||||||||
| 9 | Rh | 45 | 8 | 1 | |||||||||||||||
| 10 | Pd | 46 | 10 | ||||||||||||||||
| 11 | Ag | 47 | 10 | 1 | |||||||||||||||
| 12 | Cd | 48 | 10 | 2 | |||||||||||||||
| 13 | In | 49 | 10 | 2 | 1 | ||||||||||||||
| 14 | Sn | 50 | 10 | 2 | 2 | ||||||||||||||
| 15 | Sb | 51 | 10 | 2 | 3 | ||||||||||||||
| 16 | Te | 52 | 10 | 2 | 4 | ||||||||||||||
| 17 | I | 53 | 10 | 2 | 5 | ||||||||||||||
| 18 | Xe | 54 | 10 | 2 | 6 | ||||||||||||||
| 第6周期 | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | 6s | 6p | 6d | ||
| 1 | Cs | 55 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 2 | 6 | 1 | |||||
| 2 | Ba | 56 | 54 キセノン核 | 2 | |||||||||||||||
| 3 | La | 57 | 1 | 2 | |||||||||||||||
| 3 | Ce | 58 | 46 1s・・・・4d | 1 | 2 | 6 | 1 | 2 | |||||||||||
| 3 | Pr | 59 | 3 | 2 | 6 | 2 | |||||||||||||
| 3 | Nd | 60 | 4 | 2 | 6 | 2 | |||||||||||||
| 3 | Pm | 61 | 5 | 2 | 6 | 2 | |||||||||||||
| 3 | Sm | 62 | 6 | 2 | 6 | 2 | |||||||||||||
| 3 | Eu | 63 | 7 | 2 | 6 | 2 | |||||||||||||
| 3 | Gd | 64 | 7 | 2 | 6 | 1 | 2 | ||||||||||||
| 3 | Tb | 65 | 9 | 2 | 6 | 2 | |||||||||||||
| 3 | Dy | 66 | 10 | 2 | 6 | 2 | |||||||||||||
| 3 | Ho | 67 | 11 | 2 | 6 | 2 | |||||||||||||
| 3 | Er | 68 | 12 | 2 | 6 | 2 | |||||||||||||
| 3 | Tm | 69 | 13 | 2 | 6 | 2 | |||||||||||||
| 3 | Yb | 70 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 2 | ||||
| 3 | Lu | 71 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 1 | 2 | |||
| 4 | Hf | 72 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 2 | 2 | |||
| 5 | Ta | 73 | 68 1s・・・・5p | 3 | 2 | ||||||||||||||
| 6 | W | 74 | 4 | 2 | |||||||||||||||
| 7 | Re | 75 | 5 | 2 | |||||||||||||||
| 8 | Os | 76 | 6 | 2 | |||||||||||||||
| 9 | Ir | 77 | 7 | 2 | |||||||||||||||
| 10 | Pt | 78 | 9 | 1 | |||||||||||||||
| 11 | Au | 79 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 | 1 | |||
| 12 | Hg | 80 | 78 1s・・・・5d | 2 | |||||||||||||||
| 13 | Tl | 81 | 2 | 1 | |||||||||||||||
| 14 | Pb | 82 | 2 | 2 | |||||||||||||||
| 15 | Bi | 83 | 2 | 3 | |||||||||||||||
| 16 | Po | 84 | 2 | 4 | |||||||||||||||
| 17 | At | 85 | 2 | 5 | |||||||||||||||
| 18 | Rn | 86 | 2 | 6 | |||||||||||||||
| - | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | 6s | 6p | 6d | ||

- 作者: 富永 裕久
- 出版社/メーカー: ナツメ社
- 発売日: 2005/11
- メディア: 単行本

- 作者: 友田 修司
- 出版社/メーカー: 講談社
- 発売日: 2007/09/27
- メディア: 単行本(ソフトカバー)




コメント 0