蒸発熱と融解熱の差 [C2J-東大化学 日記]
こ( ̄0 ̄)ん( ̄ー ̄)に( ̄△ ̄)ち"<( ̄∇ ̄)>"わっはっは!!
さて、固体,液体,気体の違いは、皆さんなら説明できるでしょう。が、念のために・・・・r(-◎ω◎-)
まず、固体と液体,気体との最大の違いは、変形のしやすさでしょう。実際の物質は構成粒子からできていて、粒子間には隙間があるため厳密には連続体と言えませんが、大きな塊(物体)としてみた場合(巨視的)には連続体と見なすことが出来ます。変形させようと固体に強い力を作用させると、変形しきれずに割れる(破断)ことがありますね(剪断応力が発生)。ところが、液体や気体はわずかな力で破断することなく形が変化します。このようなものを流体と呼びます。
次に、固体,液体と気体との最大の違いは、粒子間の距離でしょう。固体,液体ともに、構成粒子は互いにほぼ密着しており、形が変化しても温度が一定であれば、密度は一定に保たれます(転移による結晶型の変化があった場合を除く)。ところが、気体は粒子間の距離がきわめて大きく、圧力によって密度が大きく変化します。ちなみに、一般的には固体より液体の方が密度が小さい(同質量で体積が大きい)のですが、水のように結晶化すると隙間の大きい構造を取るため、固体になると体積が膨張(密度が減少)する物質もあります。
※ 転移 = 単体や化合物の固体物質の集合状態が変化する現象(例えば鉄は900℃で体心立方から面心立方へと結晶構造が変化する)
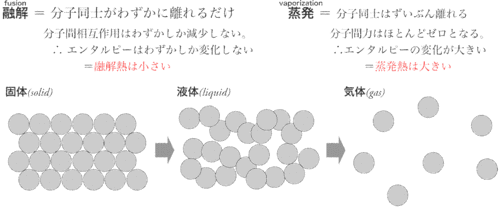
① 固体 = 粒子同士が互いに接し、粒子の相対的位置が変化しない(その場で振動)
② 液体 = 粒子同士は互いに接するが、相対的な位置が容易に変化する流体
③ 気体 = 粒子同士が大きく離れ、ほぼ自由に運動している流体
以上が整理できたところで、 融解熱と蒸発熱の違いについて考えてみましょう o( ̄ー ̄;)ゞ
状態変化(相転移)に伴う熱を転移熱と云い、固体から液体への転移熱が融解熱,液体から気体への転移熱が蒸発熱です。どの相転移も粒子間の結合を切る反応なので、エネルギーを吸収する吸熱反応となります。固体が分子結晶の場合は分子間結合(分子間力など分子間に作用する結合),金属結晶の場合は金属結合,イオン結晶の場合はイオン結合,共有結合結晶の場合は共有結合(黒鉛は層状構造間の分子間力を含む)を切らなければなりません 三(  ̄0 ̄)/"ヤァッ
融解は固体から液体への変化ですから、完全に粒子同士が離れてしまうわけではありません。つまり、完全に粒子間の結合が切れるわけではないため、結合を切るのに必要なエネルギーは少なくて済みます(融解熱は比較的小さい)。それに対して、蒸発は液体から気体への変化なので、粒子間の結合をほぼ完全に切ってしまわないといけません。従って、結合を切るのに必要なエネルギーは大きくなります(蒸発熱は結合力に比例して大きくなる)。例えば、水の融解熱は6.0kJ/molですが、蒸発熱は44kJ/mol(温度によって変化)になります。なお、ヘスの総熱量不変の法則(熱力学第一法則)より、固体から直接気体へ変化する昇華に要する昇華熱は、融解熱と蒸発熱の合計になることは分かりますよね “ヘ( ̄∇ ̄ )
※ 転移熱は変化の方向によって熱の出入りが明らかなので、符号は付けずに絶対値表記するのが一般的です。例えば、凝縮は蒸発の逆の反応ですが、凝縮熱 = 蒸発熱となります(例えば水なら44kJ/mol)。
ちなみに昇華熱は、固体の構成粒子から結晶格子が生じる熱でもあるので、イオン結晶を除き格子エネルギーと等しくなります(例えばヨウ素は昇華熱も格子エネルギーも62.3kJ/mol,ナトリウムは昇華熱も格子エネルギーも108kJ/mol)ヾ(*⌒∇⌒)八(⌒∇⌒*)ツ一緒っ!!
イオン結晶は昇華するとイオン対(例えば塩化ナトリウムなら二原子分子NaCl)になるため昇華熱は215kJ/molと、イオンがバラバラになる格子エネルギーの777kJ/molよりかなり小さくなります w( ̄Д ̄;)wワオッ!!
東大のボルン・ハーバーサイクル問題でも、気体のNaClと固体のNaClの生成熱の違いについての設問がありましたよねd( ̄  ̄)




コメント 0